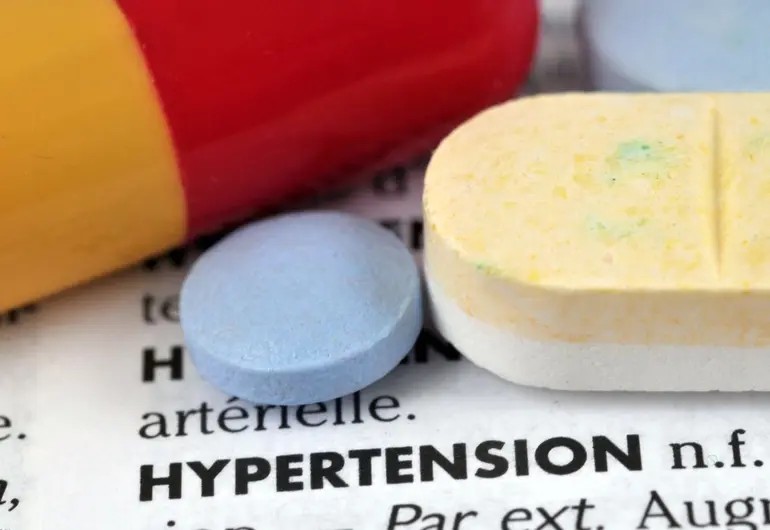
La FDA retira medicamento para la presión arterial por contaminante cancerígeno tras detectar niveles elevados de nitrosaminas, sustancias químicas asociadas a un mayor riesgo de cáncer. El retiro afecta miles de lotes del fármaco Prazosin Hydrochloride distribuidos en EE. UU.
La Food and Drug Administration (FDA) anunció la retirada de más de 580 000 botellas del fármaco Prazosin Hydrochloride tras detectar niveles de la impureza nitrosamina “N‑nitroso Prazosin Impurity C” que excedían los límites aceptados.
El fármaco Prazosin Hydrochloride, prescrito para tratar hipertensión arterial y algunas veces trastornos del sueño vinculados al estrés postraumático, estaba fabricado por Teva Pharmaceuticals USA. Según informes de la FDA, los lotes afectados contenían niveles de la nitrosamina mencionada que rebasaban los límites aceptables establecidos por el enfoque de Categoría de Potencia Carcinogénica (CPCA) de la agencia.
La clasificación del retiro fue “Clase II”, lo que significa que la exposición “puede causar efectos adversos temporales o médicamente reversibles, o donde la probabilidad de efectos graves es remota”.
Para los pacientes este anuncio implica un doble reto: seguir controlando su presión arterial y, al mismo tiempo, revisar su tratamiento ante la posibilidad de estar tomando un lote comprometido.

 Operación Frontera Norte asegura 90 mdp en precursores
Operación Frontera Norte asegura 90 mdp en precursores  144 jornadas de paz e intercambio de 386 armas en Puebla por Atención a las Causas: Segob
144 jornadas de paz e intercambio de 386 armas en Puebla por Atención a las Causas: Segob  Próxima semana FGR entregará dictamen del Tren Interoceánico: Sheinbaum
Próxima semana FGR entregará dictamen del Tren Interoceánico: Sheinbaum  Arrestan a tres hombres en posesión de arma y droga en Lomas de Becerra
Arrestan a tres hombres en posesión de arma y droga en Lomas de Becerra  Inflación da un respiro para el cierre del año; primera quincena de diciembre
Inflación da un respiro para el cierre del año; primera quincena de diciembre  Presidente InterContinental Monterrey señala las tendencias 2026 en viajes de lujo
Presidente InterContinental Monterrey señala las tendencias 2026 en viajes de lujo